刘峰/张勇合作揭示染色质重塑因子Smarca5介导的表观遗传调控促进胚胎期造血干祖细胞的发育
作者:luojiao 发布时间:2021/4/2 12:00:00撰文 | 丁岩岩
在脊椎动物中,最早的新生造血干祖细胞(hematopoietic stem and progenitor cells,HSPCs),是由位于主动脉-性腺-中肾区(aorta-gonad-mesonephros,AGM)动脉腹侧的生血内皮经过内皮-造血转化过程产生的 [1-3]。随后,造血干祖细胞迁移到哺乳动物的胎肝(fetal liver,FL)或斑马鱼的尾部造血组织(caudal hematopoietic tissue,CHT)进行快速扩增和分化 [4, 5]。以往的研究表明,AGM区新产生的造血干细胞与胎肝中的造血干细胞存在转录以及移植能力的差异 [6-8]。然而,关于造血干祖细胞从产生到扩增,其染色质以及分子水平的变化和调控机制尚知之甚少。
2021年1月,中国科学院动物研究所刘峰研究员团队与同济大学张勇教授团队合作在BLOOD杂志发表了题为Smarca5-mediated epigenetic programming facilitates fetal HSPC development in vertebrates的研究论文。该工作发现:在处于产生和扩增/分化等不同发育阶段的造血干祖细胞中,染色质可接近性和转录组存在动态变化。深入机制探索发现,染色质重塑因子Smarca5通过与核仁蛋白Nucleolin相互作用,促进染色质重塑,调控造血相关的转录因子与基因组结合,进而促进造血干祖细胞发育。
.png)
论文首先通过对斑马鱼AGM区新产生的造血干祖细胞以及处于扩增/分化阶段的CHT区造血干祖细胞进行ATAC-seq和RNA-seq分析,研究人员发现,染色质开放性在AGM区和CHT区造血干祖细胞中存在动态变化;与AGM区新生造血干祖细胞相比,造血相关基因的染色质开放性在CHT区造血干祖细胞中更加富集(图1A和B)。同时,造血相关基因的表达水平在CHT区造血干祖细胞中更高。在AGM区和CHT区造血干祖细胞中,RNA-seq和ATAC-seq数据具有显著的相关性(图1C)。相比远端调控区,启动子区的染色质开放程度对于基因的转录影响更为明显(图1D)。以上结果暗示,CHT区造血干祖细胞具有更加稳定和特异的造血能力。
.png)
图1 胚胎期AGM区与CHT区造血干祖细胞的染色质可接近性及转录组解析
为了寻找调控造血干祖细胞发育过程中染色质状态变化的关键染色质重塑因子,研究人员结合染色质重塑因子在AGM区和CHT区造血干祖细胞中的表达以及功能实验分析,证实Smarca5通过调节染色质可接近性促进CHT区造血干祖细胞的发育(图2A和B)。此外,通过质谱检测和生化实验,研究人员发现核仁蛋白Nucleolin可以与Smarca5相互作用(图2C)。进一步机制研究表明,Nucleolin有助于Smarca5介导的染色质重塑,进而影响与造血干祖细胞增殖和分化相关的转录因子(包括:Klf1和Spi1)与基因组的结合(图2D和E)。例如:Smarca5缺失影响了Spi1在bcl11ab启动子区的结合,导致bcl11ab表达下调, 进而造成CHT区造血干祖细胞发育缺陷(图2F)。
.png)
图2 Smarca5通过与Nucleolin相互作用促进染色质重塑
综上所述,该研究揭示了表观遗传调控在各造血组织中不同阶段的造血干祖细胞发育的重要性。在造血干祖细胞的产生和扩增/分化等不同发育阶段中,染色质可接近性和转录组存在动态变化,并伴随着染色质重塑因子的动态表达。其中,染色质重塑因子Smarca5通过与核仁蛋白Nucleolin相互作用,促进染色质重塑,调控造血相关的转录因子与基因组结合,进而促进造血干祖细胞发育(图3)。
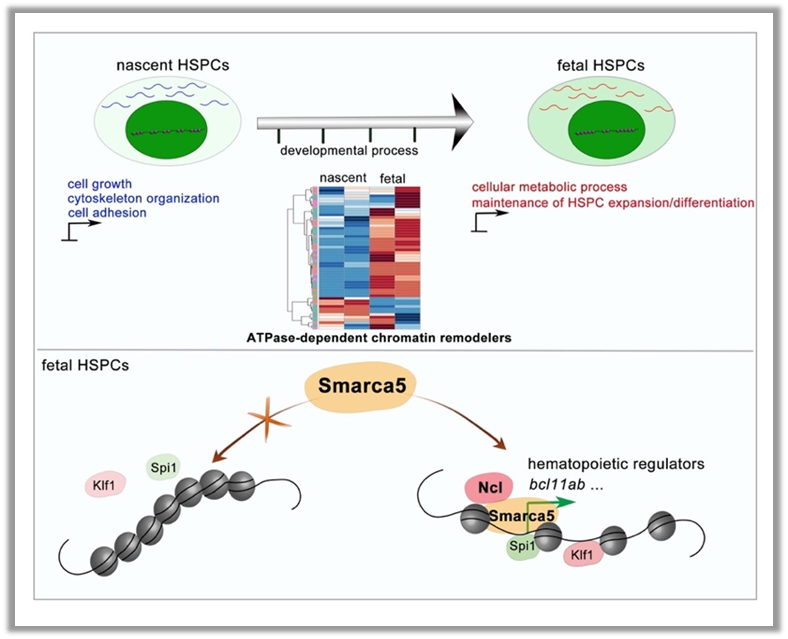
图3 Smarca5介导的表观遗传调控促进胚胎期造血干祖细胞的发育
刘峰研究员与张勇教授为论文共同通讯作者。博士研究生丁岩岩与王文为共同第一作者。该研究得到了国家重点研发计划、国家自然科学基金以及中国科学院的资助。据悉,该研究涉及的斑马鱼品系,已保藏至国家水生生物种质资源库国家斑马鱼资源中心。
参考文献:
1. Bertrand JY, Chi NC,Santoso B, Teng ST, Stainier DYR, Traver D: Haematopoietic stem cells derive directly from aortic endothelium during development. Nature 2010, 464(7285):108-U120.
2. KissaK, Herbomel P: Blood stem cells emerge from aortic endothelium by a novel type of cell transition. Nature 2010, 464(7285):112-U125.
3. BoissetJC, van Cappellen W, Andrieu-Soler C, Galjart N, Dzierzak E, Robin C: In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature 2010, 464(7285):116-U131.
4. MurayamaE, Kissa K, Zapata A, Mordelet E, Briolat V, Lin HF, Handin RI, Herbomel P: Tracing hematopoietic precursor migration to successive hematopoietic organs during zebrafish development. Immunity 2006, 25(6):963-975.
5. XueYY, Lv JH, Zhang CX, Wang L, Ma DY, Liu F: The Vascular Niche Regulates Hematopoietic Stem and Progenitor Cell Lodgment and Expansion via klf6a-ccl25b. Dev Cell 2017,42(4):349-+.
6. McKinney-FreemanS, Cahan P, Li H, Lacadie SA, Huang HT, Curran M, Loewer S, Naveiras O,Kathrein KL, Konantz M et al: The Transcriptional Landscape of Hematopoietic Stem Cell Ontogeny. Cell Stem Cell 2012,11(5):701-714.
7. RybtsovS, Ivanovs A, Zhao SL, Medvinsky A: Concealed expansion of immature precursors underpins acute burst of adult HSC activity infoetal liver. Development 2016, 143(8):1284-1289.
8. AroraN, Wenzel PL, McKinney-Freeman SL, Ross SJ, Kim PG, Chou SS, Yoshimoto M, YoderMC, Daley GQ: Effect of Developmental Stage of HSC and Recipient on Transplant Outcomes. Dev Cell 2014, 29(5):621-628.