刘峰课题组从单细胞水平揭示造血干细胞扩增的动态图谱
作者:luojiao 发布时间:2021/4/2 3:00:00编辑 | 谢训卫
造血干细胞具有自我更新和分化的生物学特征,既可以维持其自身在造血组织中的恒定数量,同时又能向红系、粒系、巨核系和淋巴系等多种血细胞分化[1,2]。众所周知,造血干细胞移植广泛应用于白血病、再生障碍性贫血、骨髓增生异常综合征等临床血液系统恶性肿瘤的治疗[3],然而,造血干细胞来源不足却成为限制其广泛应用的瓶颈。因此,如何模拟体内造血干细胞扩增并实现临床转化应用一直备受关注[4]。
斑马鱼造血干/祖细胞(Hematopoietic stem/progenitor cells, HSPCs)扩增和分化的重要场所是尾部造血组织(Caudal hematopoietic tissue, CHT)[5,6]。CHT是一个高度血管化的微环境结构,包括尾部主动脉、尾部主静脉、尾部静脉血管丛(Caudal vein plexus, CVP)以及大量的成纤维网状细胞和多种血细胞[7,8]。其中,各个组分的有序及精细的调控对微环境的稳态维持至关重要。刘峰课题组前期已利用多维多重转录组技术,系统阐释了造血干细胞和微环境细胞之间的分子调控网络[9]。然而,对造血干细胞扩增和分化的时间区段内,血管微环境的细胞复杂性、功能可塑性及动态协同发育过程的研究十分有限。
2021年3月30日,中科院动物研究所刘峰课题组在PNAS杂志上发表题为“A single-cell resolution developmental atlas of hematopoietic stem and progenitor cell expansion in zebrafish”的研究论文。该研究描绘了扩增性造血组织的动态单细胞发育图谱,深入解析了造血干细胞扩增的细胞基础和分子机制。

造血干细胞具有自我更新和分化的生物学特征,既可以维持其自身在造血组织中的恒定数量,同时又能向红系、粒系、巨核系和淋巴系等多种血细胞分化[1,2]。众所周知,造血干细胞移植广泛应用于白血病、再生障碍性贫血、骨髓增生异常综合征等临床血液系统恶性肿瘤的治疗[3],然而,造血干细胞来源不足却成为限制其广泛应用的瓶颈。因此,如何模拟体内造血干细胞扩增并实现临床转化应用一直备受关注[4]。
斑马鱼造血干/祖细胞(Hematopoietic stem/progenitor cells, HSPCs)扩增和分化的重要场所是尾部造血组织(Caudal hematopoietic tissue, CHT)[5,6]。CHT是一个高度血管化的微环境结构,包括尾部主动脉、尾部主静脉、尾部静脉血管丛(Caudal vein plexus, CVP)以及大量的成纤维网状细胞和多种血细胞[7,8]。其中,各个组分的有序及精细的调控对微环境的稳态维持至关重要。刘峰课题组前期已利用多维多重转录组技术,系统阐释了造血干细胞和微环境细胞之间的分子调控网络[9]。然而,对造血干细胞扩增和分化的时间区段内,血管微环境的细胞复杂性、功能可塑性及动态协同发育过程的研究十分有限。
2021年3月30日,中科院动物研究所刘峰课题组在PNAS杂志上发表题为“A single-cell resolution developmental atlas of hematopoietic stem and progenitor cell expansion in zebrafish”的研究论文。该研究描绘了扩增性造血组织的动态单细胞发育图谱,深入解析了造血干细胞扩增的细胞基础和分子机制。

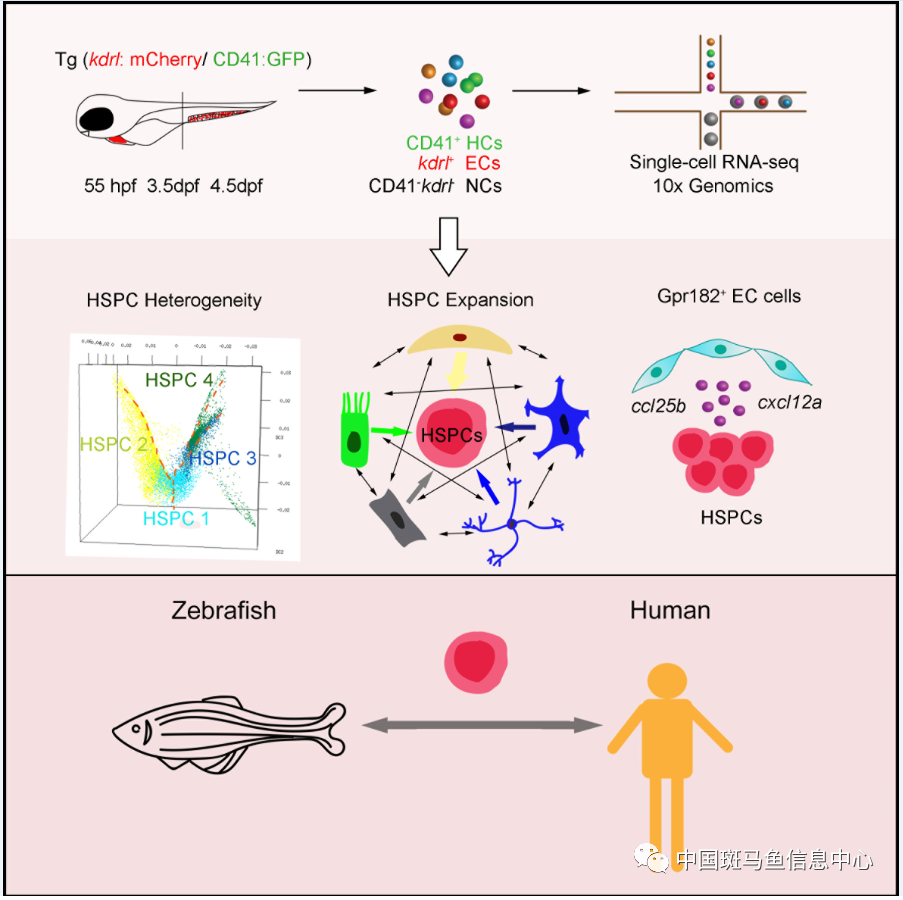
利用单细胞转录组测序技术,研究人员选取3个造血干细胞发育的重要时间点(55hpf,3.5hpf,4.5hpf)对斑马鱼尾部造血组织28777个细胞(包含HSPCs,内皮细胞及非内皮/HSPCs细胞)进行深入分析。首先,研究人员鉴定出斑马鱼尾部造血组织不同分化倾向性的HSPCs和各谱系血细胞。其次,通过对CHT微环境成分的深入解析,研究人员发现CHT存在动态发育过程,即微环境细胞协同HSPCs发育。研究人员还鉴定了一群特殊的促扩增内皮细胞和其特异的微环境因子Gpr182。斑马鱼体内功能实验证明,Gpr182可以促进HSPCs在尾部造血组织的扩增,并且Gpr182的功能在小鼠中是保守的。最后,通过将斑马鱼尾部造血组织和人胎肝的单细胞数据进行比对分析,研究人员发现二者在进化上具有保守的细胞类群基因表达,而其差异性则体现在细胞类型组成和HSPC的转录组特征,即:斑马鱼的扩增性造血组织的HSPC更能适应温度变化,人胎肝中的HSPC具有更强的免疫特征。上述结果暗示了造血干细胞对环境的适性进化。
综上所述,该研究对斑马鱼扩增性造血组织的动态发育、造血干细胞扩增的细胞学基础提出了更深度的理解,为HSPCs的体外高效扩增提供了新的理论指导。
综上所述,该研究对斑马鱼扩增性造血组织的动态发育、造血干细胞扩增的细胞学基础提出了更深度的理解,为HSPCs的体外高效扩增提供了新的理论指导。

图1 单细胞转录组测序解析斑马鱼尾部造血组织。在3个造血干细胞发育的重要时间点(55hpf,3.5hpf,4.5hpf)
对尾部造血组织的细胞(包含造血干/祖细胞皮,内细胞及非内皮造血干/祖细胞)进行深入分析。从中鉴定了不
同分化潜能的造血干/祖细胞,建立了复杂有序的微环境细胞和HSPC的互作网络,发现了一群特殊的促扩增内皮细
胞和特异表达因子Gpr182。通过对斑马鱼尾部造血组织和人胎肝造血发育的进化分析,发现了造血干细胞在不同物种
中的转录组特征存在异同。
参考文献:
1. E.Laurenti, B. Gottgens, From haematopoietic stem cells to complex differentiation landscapes. Nature 553, 418-426 (2018).
2. Y.Zhang, S. Gao, J. Xia, F. Liu, Hematopoietic Hierarchy - An Updated Roadmap. Trends Cell Biol 28, 976-986 (2018).
3. C. R.Mantel et al., Enhancing Hematopoietic Stem Cell Transplantation Efficacy by Mitigating Oxygen Shock. Cell 161, 1553-1565 (2015).
4. A. C.Wilkinson, K. J. Igarashi, H. Nakauchi, Haematopoietic stem cell self-renewal in vivo and ex vivo. Nat Rev Genet 21, 541-554 (2020).
5. J. R.Perlin, A. L. Robertson, L. I. Zon, Efforts to enhance blood stem cell engraftment: Recent insights from zebrafish hematopoiesis. J Exp Med 214, 2817-2827(2017).
6. S. H.Orkin, L. I. Zon, Hematopoiesis: an evolving paradigm for stem cell biology. Cell 132, 631-644 (2008).
7. E.Murayama et al., Tracing hematopoietic precursor migration to successive hematopoietic organs during zebrafish development. Immunity 25, 963-975 (2006).
8. Y. Xue et al., The Vascular Niche Regulates Hematopoietic Stem and Progenitor Cell Lodgment and Expansion via klf6a-ccl25b.Dev Cell 42, 349-362 e344 (2017).9. Y. Xue et al., A 3D Atlas of Hematopoietic Stem and Progenitor Cell Expansion by Multi-dimensional RNA-Seq Analysis. Cell Rep 27, 1567-1578 e1565 (2019).
1. E.Laurenti, B. Gottgens, From haematopoietic stem cells to complex differentiation landscapes. Nature 553, 418-426 (2018).
2. Y.Zhang, S. Gao, J. Xia, F. Liu, Hematopoietic Hierarchy - An Updated Roadmap. Trends Cell Biol 28, 976-986 (2018).
3. C. R.Mantel et al., Enhancing Hematopoietic Stem Cell Transplantation Efficacy by Mitigating Oxygen Shock. Cell 161, 1553-1565 (2015).
4. A. C.Wilkinson, K. J. Igarashi, H. Nakauchi, Haematopoietic stem cell self-renewal in vivo and ex vivo. Nat Rev Genet 21, 541-554 (2020).
5. J. R.Perlin, A. L. Robertson, L. I. Zon, Efforts to enhance blood stem cell engraftment: Recent insights from zebrafish hematopoiesis. J Exp Med 214, 2817-2827(2017).
6. S. H.Orkin, L. I. Zon, Hematopoiesis: an evolving paradigm for stem cell biology. Cell 132, 631-644 (2008).
7. E.Murayama et al., Tracing hematopoietic precursor migration to successive hematopoietic organs during zebrafish development. Immunity 25, 963-975 (2006).
8. Y. Xue et al., The Vascular Niche Regulates Hematopoietic Stem and Progenitor Cell Lodgment and Expansion via klf6a-ccl25b.Dev Cell 42, 349-362 e344 (2017).9. Y. Xue et al., A 3D Atlas of Hematopoietic Stem and Progenitor Cell Expansion by Multi-dimensional RNA-Seq Analysis. Cell Rep 27, 1567-1578 e1565 (2019).