兰州大学与卡尔斯鲁厄理工学院利用斑马鱼和洞穴鱼模型合作揭示阳光诱导DNA损伤及修复的进化机制
作者:luojiao 发布时间:2021/4/12 12:00:00
编辑 | 熊 凤
DNA完整性是生命系统生存的基础。紫外(UV)辐射作为诱导DNA损伤最普遍的因素,能够导致相邻嘧啶之间形成共价连接,从而形成环丁烷嘧啶二聚体(CPDs)和6-4光产物(6-4PPs)等。光修复(Photoreactivation)作为最高效的DNA修复系统,利用可见光的能量,通过光裂合酶的酶促反应修复UV诱导的DNA损伤。光裂合酶是一类广泛存在于动植物及单细胞生物的古老蛋白,而有趣的是,人和小鼠等胎盘哺乳动物在进化中丢失了这一重要而保守的修复功能,转而依赖于相对复杂而低效的核苷酸切除修复(NER)。前期研究表明,索马里洞穴鱼(Phreatichthys andruzzii)由于在完全隔绝阳光照射的环境中进化了至少300万年,已经完全缺失了光修复功能,可能是目前所发现的除胎盘哺乳动物外唯一丢失了进化中高度保守的光修复功能的物种。结合“夜行瓶颈”假说,我们推测索马里洞穴鱼可能同样经历了中生代哺乳动物的祖先在进化中逐渐丢失光修复功能的初步阶段[1]。
那么,在完全没有可见光和UV损伤的环境下,其它应对UV损伤的DNA修复机制是否也在索马里洞穴鱼中受到类似影响?2021年2月5日,兰州大学生命科学学院赵海谕青年研究员与德国卡尔斯鲁厄理工学院生物与化学系统研究所(KIT-IBCS)Foulkes研究团队合作在PLOS GENETICS杂志发表了题为“Regulation of ddb2 expression in blind cavefish and zebrafish reveals plasticity in the control of sunlight-induced DNA damage repair”的研究论文,通过对比“表层”模式动物斑马鱼和极端模型索马里洞穴鱼,证实了在黑暗中进化了数百万年的索马里洞穴鱼依然具备通过NER修复UV诱导DNA损伤的能力。

作者通过将ddb2基因启动子区域克隆到荧光素酶报告基因载体并转染至斑马鱼和洞穴鱼细胞,发现斑马鱼ddb2启动子中的两个具有回文序列的D-box增强子元件对于通过可见光和ROS诱导基因表达是必要且充分的,但在洞穴鱼细胞中,ddb2基因的诱导表达依赖于D-box增强子和临近E2F结合位点的协同作用,而且,洞穴鱼和斑马鱼的ddb2基因均受到UV照射的强烈诱导。因此,与DNA光修复相关基因的调控不同,洞穴鱼NER相关基因仍保留了对可见光、ROS和UV的高度敏感响应(图1)。更有趣的是,在UV瞬时照射下,作者观察到在斑马鱼细胞中所有DNA修复相关基因的mRNA稳定性显著增加,而在洞穴鱼细胞中只观察到NER 相关基因mRNA稳定性的显著提升。因此,通过比较“表层”模式动物斑马鱼和在持续黑暗中进化了数百万年的索马里洞穴鱼模型,作者揭示了在长期环境因素的挑战下阳光诱导DNA损伤以及修复的复杂性转录、转录后调控机制。
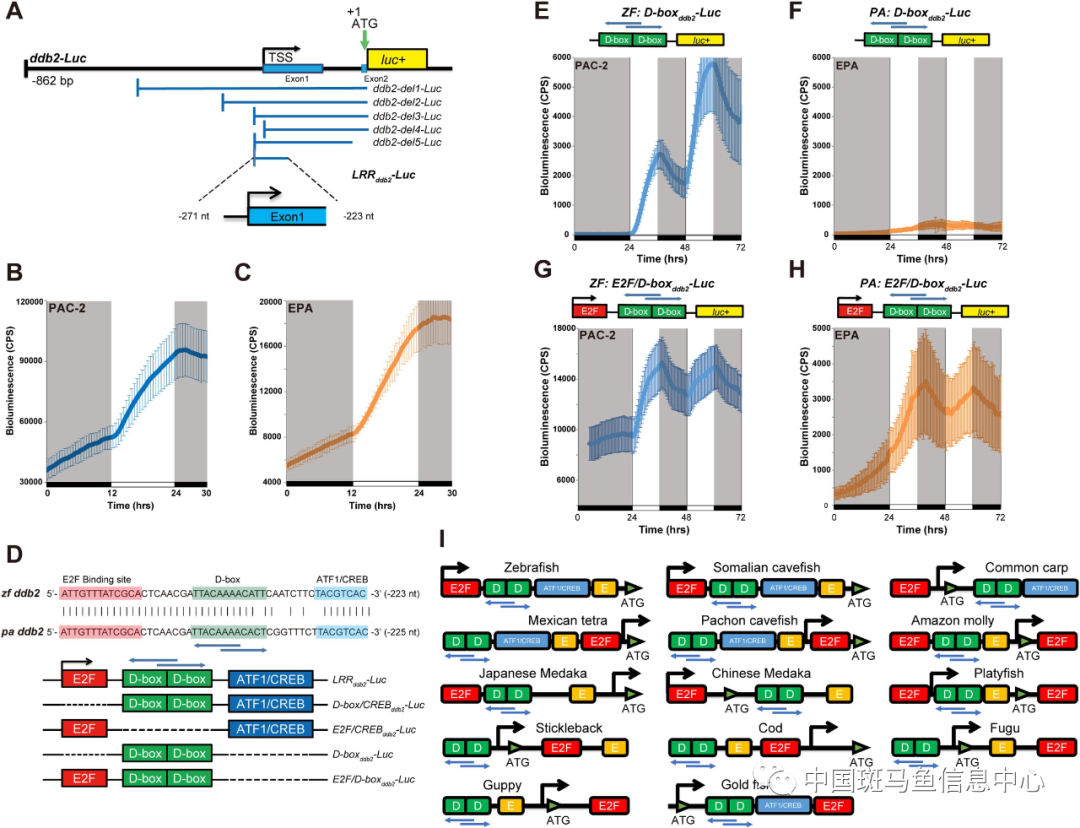
图1 ddb2启动子的光反映元件
德国海德堡大学和卡尔斯鲁厄理工学院Nicholas S. Foulkes教授为该论文的通讯作者,兰州大学生命科学学院赵海谕为该论文的第一作者。该研究得到了亥姆霍兹BIFTM项目、兰州大学科研启动经费和中央高校基本科研业务费等项目的资助。
参考文献:
1. Zhao, H., et al., Modulation of DNA Repair Systems in Blind Cavefish during Evolution in Constant Darkness. Curr Biol, 2018. 28(20): p. 3229-3243 e4.