斑马鱼模式动物: 解密各类罕见遗传疾病
作者:CZRC 发布时间:2024/3/21 10:00:00
“瓷娃娃”“蝴蝶宝贝”“月亮的孩子”……这些名字背后,是离我们并不遥远的罕见病。让罕见被看见,让爱不罕见!目前,我国已有207种“法定”罕见病,2023年12月,126个药品新增进入国家医保药品目录,包括15种罕见病用药,涉及戈谢病、重症肌无力、视神经脊髓炎谱系疾病等。
研究表明,80%以上的罕见病由遗传因素导致。近年来,斑马鱼由于其与人类基因高度相似、胚胎透明易于观察等独特的生物学特性,可用于模拟人类罕见病的发生和发展过程,因此,已成为白化病、视网膜变性、肌无力症、神经系统疾病、心血管疾病等诸多罕见病研究与治疗的理想工具,呈现出巨大的应用潜力。
01
斑马鱼在罕见病中的研究方向
当前,随着斑马鱼研究的不断深入与基因编辑技术的发展,研究人员利用斑马鱼模型,不仅可以深入了解罕见病的发病机制,加速药物筛选、治疗药物的开发,而且,为开发治疗罕见病的疗法提供支持,助力罕见病临床研究,为罕见病患者带来更好的治疗前景。其研究方向主要包括以下几个方面:
用于罕见病模型的建立
利用斑马鱼可以构建各种罕见病模型,通过进行斑马鱼基因型、表型分析,确保具有与所研究罕见病相关的特定基因突变和相应的疾病表现,也可以通过分析斑马鱼运动行为轨迹等来研究罕见病的运动障碍,模拟人类疾病的发生和发展过程,从而有助于深入研究罕见病的发病机制。
用于罕见病药物筛选与评估
斑马鱼可用于罕见病的大规模药物筛选,通过在斑马鱼体内引入人类罕见病相关的基因突变,观察药物对这些突变的影响,从而筛选出可能具有治疗效果的药物,也可以用于评估药物对罕见病的治疗效果,以及药物的副作用和安全性等,并对筛选出的药物或治疗策略进行进一步验证,为罕见病的治疗提供新的思路和方法。
用于罕见病基因治疗研究
通过基因编辑技术,精确地敲除或修改与罕见病相关的基因,并将正常的基因导入斑马鱼体内以替代或修正突变的基因,从而观察治疗效果,评估基因治疗的安全性和有效性,帮助研究人员评估基因治疗策略的可行性,为临床应用提供参考。
用于毒理学研究
斑马鱼不仅可以用于罕见病中大规模药物、化学物质的毒性筛选与药效评估,还可以通过评估斑马鱼模型对化合物暴露后的发育异常、死亡率、器官结构和功能异常等指标,评估其对人类和环境的潜在毒性,深入研究环境污染物和药物等毒理学作用机制和代谢过程,对保障人类健康和环境安全具有重要意义。
02
斑马鱼在罕见病中的应用案例
近年来,作为一种新兴的研究工具,斑马鱼在罕见病研究中的应用案例不断涌现,这些案例充分展示了斑马鱼作为模式动物在罕见病研究中的潜力和价值。
瞄准致病基因,挽救重症淋巴病男孩
研究对象:通过斑马鱼例证基因的发现如何影响疾病分类,并找出挽救生命的新型生物疗法,为治疗淋巴循环缺陷打下基础。
2019年6月,《Nature Medicine》杂志上发布了费城儿童医院(CHOP)儿科肺科专家和应用基因组学中心主任Hakon Hakonarson团队利用斑马鱼基因编辑技术,对危及生命的罕见疾病实施精准药物治疗的戏剧性案例。


重症淋巴病男孩丹尼尔生命垂危,研究团队对丹尼尔的基因组中表达蛋白的部分进行了测序,然而,在通常与淋巴系统异常相关的基因中,研究人员并没有发现任何异常。
为了探明ARAF的基因突变是丹尼尔疾病的罪魁祸首还是与疾病无关的基因突变,研究人员利用模式动物——斑马鱼在显微镜下观察到淋巴系统的发育情况,只需要五天,斑马鱼就生成了一套淋巴系统。研究人员把丹尼尔的基因突变导入斑马鱼胚胎中,荧光蛋白标记出的淋巴系统向研究人员展现了基因突变的结果,与跟丹尼尔身上的症状一模一样!
发现“导致淋巴管过度增生的基因突变”这一重要科学成果后,研究人员又找来10种不同的MEK抑制剂,将它们喂给携带ARAF基因突变的斑马鱼,以寻找一种能够终止淋巴管异常生长但无不良影响的药物,挽救丹尼尔的生命。3个月后,丹尼尔成功脱险。
该研究首次证明了一种药物可以完全重塑整个器官系统,并为许多患有类似淋巴管流动障碍的患者带来了希望。
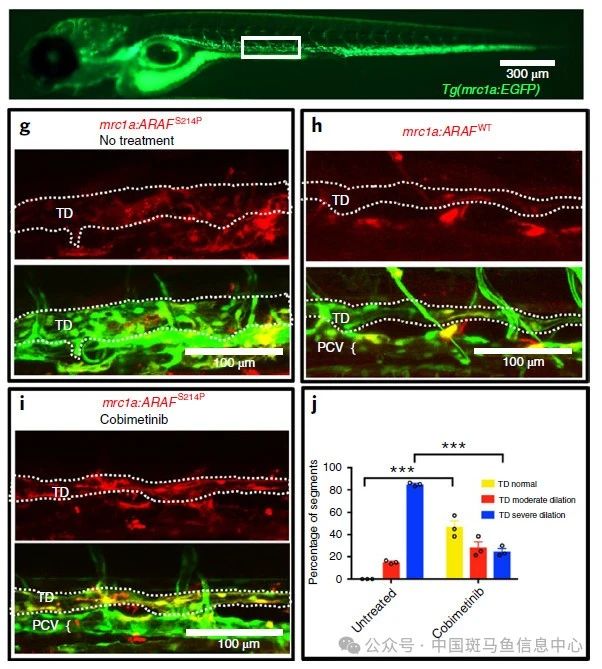

利用稀有拷贝数变异分析,在有先天性心脏缺陷的异位综合征患者中发现新的候选基因
研究对象:探讨稀有拷贝数变异在异位综合征发病机制中的作用。
异位综合征是由左、右身体形态畸形引起的一类先天性疾病。约90%的异位患者有严重的先天性心脏病;因此,异位综合征患者的生存率和预后都令人不满意。然而,大多数异位综合征病例的潜在病因和机制仍不清楚。
研究人员在收集了63例散发的异位综合征患者的先天性心脏缺陷,并确定罕见的拷贝数变异使用Affymetrix细胞扫描HD芯片和实时聚合酶链反应。通过查阅以往有关左右发育的文献,选择了与罕见拷贝数变异相关的潜在候选基因。通过原位杂交、morpholino敲降、CRISPR/Cas9介导的突变和过表达等方法进一步分析候选基因的表达模式和功能。
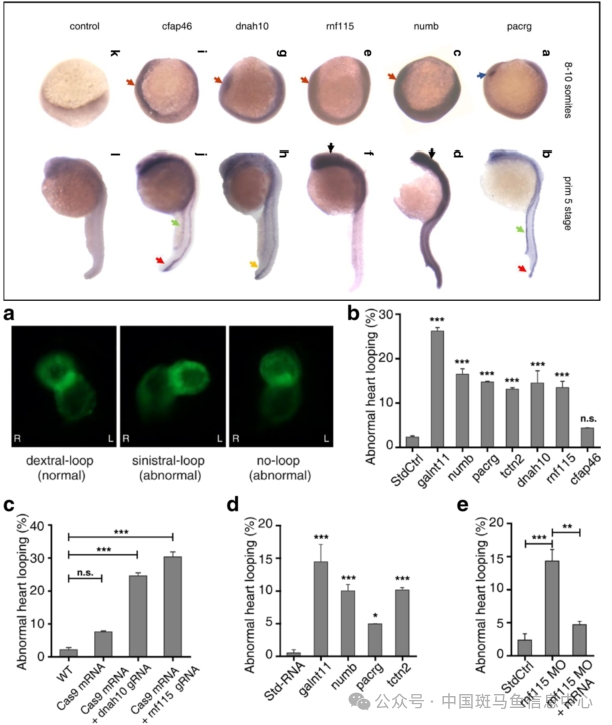
研究结果表明,在一些偶发性的先天性心脏缺陷患者中,异位综合征可能归因于罕见的拷贝数变异。此外,DNAH10和RNF115是异位综合征参与左右模式的候选基因,此前在人类或动物中都没有报道过。我们的结果也促进了对Htx遗传成分的理解[1]。

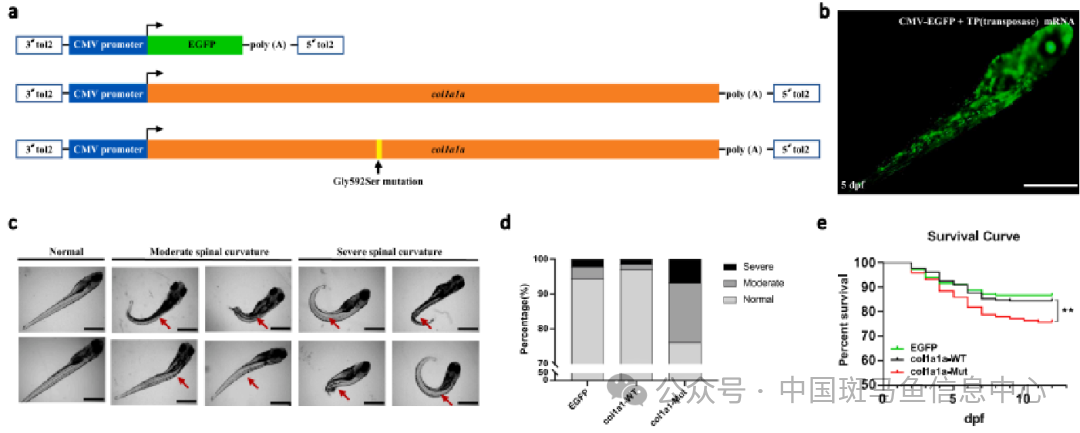
用斑马鱼模型证实COL1A1新的突变导致成骨不全
研究对象:利用斑马鱼模型验证一种新的COL1A1 突变导致的成骨不全症。
成骨不全症(OI)是一种罕见的遗传性疾病,以骨脆性和反复骨折为特征。胶原蛋白是一个蛋白质家族加强和支持身体的许多组织,I 型胶原蛋白构成人体 90% 的胶原蛋白,对于COL1A1 突变谱的研究,对于研究 OI 的遗传原因,特别是产前诊断是非常重要的。斑马鱼被报道可以作为各种疾病的临床前动物模型,对于骨骼生成及其分子途径中的关键调节因子已被证明在斑马鱼和哺乳动物之间是保守的。已经报道了几种能够准确模拟人类骨骼疾病的斑马鱼突变体,例如褶边鳍、微波和吉娃娃,所有的突变体都导致了 OI 样表型。
研究人员通过分别构建对照组、原始序列组和突变序列组,结果转录后,分别注射到斑马鱼胚胎中,统计表型-骨骼的变化。利用斑马鱼模型,通过表型观察,发现突变 COL1A1上的特定位点影响骨骼的发育,报道了一种新的COL1A1 的突变位点,这个突变点对于成骨不全症具有重要作用[2]。

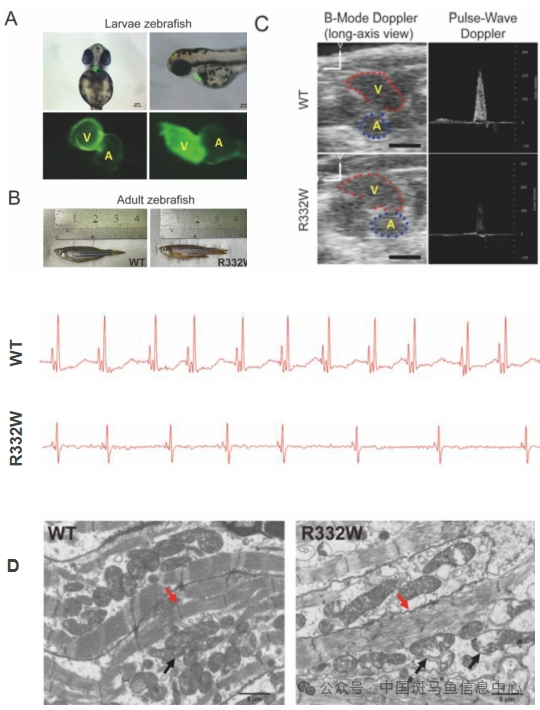
代心手综合征谱系中的家族性心房心肌病携带2B棒状结构域的LMNA错义变异(p.R335W)
研究对象:利用斑马鱼模型研究致病基因在心房病变中的作用,及早提示病患心脏健康,预防中风风险。
心房心肌病已成为一个明确的实体,可进展为心房老化,心房衰竭,并最终导致严重后果(如心衰、中风、生活质量恶化),特别是在有遗传缺陷的情况。原发性心房心肌病可能是核纤层蛋白病的早期表型。
通过斑马鱼转基因模型构建、心电图、心超、病理学检测等,研究人员鉴定了一个携带LMNA p.R335W突变大的心手综合征谱系。综合电脑模拟、体外和体内验证的方法证明R335W变异对心房致病性的有效性。此外,我们推断老化和DNA修复功能障碍可能是心房病变的潜在机制。这项研究证实心房心肌病是核纤层蛋白病的早期表型,对这些患者应及早进行干预[3]。

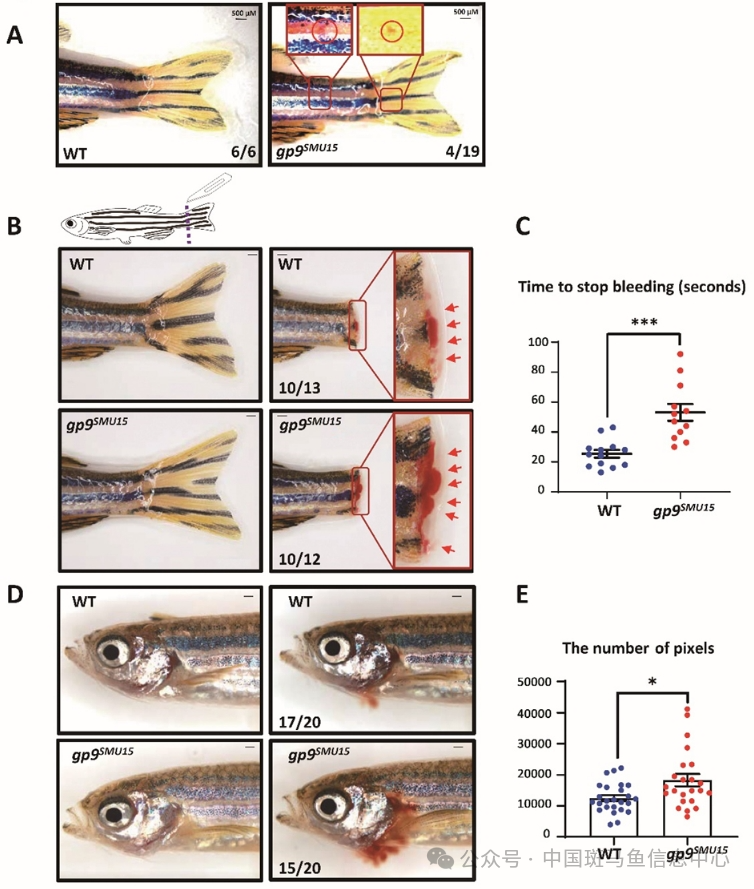
建立斑马鱼巨大血小板综合征疾病模型
研究对象:利用斑马鱼巨大血小板综合征疾病模型,验证患者来源的GP9变异的不确定意义,开发潜在的BSS治疗策略,筛选临床治疗的有效药物
巨大血小板综合征(Bernard Soulier Syndrome: BSS)为一种罕见的遗传性出血性疾病,源于血小板膜上的糖蛋白复合体GPIb-IX-V的缺陷。作为GPIb-IX-V亚基之一,GP9缺陷被认为会导致BSS疾病的发生。多种GP9的突变导致病人出现BSS的临床表征。
为了在动物模型中验证临床不明意义的突变及开发更优化的疾病治疗策略,研究者利用斑马鱼为研究工具,发现斑马鱼gp9的缺陷导致血小板减少和高出血倾向,以及祖细胞的异常增生,证明了Gp9在血小板生成过程中的高度保守,并且gp9SMU15突变体斑马鱼可以作为精准模拟人类BSS的疾病动物模型(ZebrafishAdvance | 华南理工大学张译月组建立了斑马鱼巨大血小板综合征疾病模型 (qq.com))。
研究人员利用该模型验证了临床GP9突变的体内功能,验证了促血小板药物的效果,完成了BSS疾病模型的构建以及应用开发。因此,斑马鱼巨大血小板综合征疾病模型可以用于验证患者来源的GP9变异的不确定意义,开发潜在的BSS治疗策略,筛选临床治疗的有效药物,为临床治疗提供新思路[4]。

让罕见被看见,让爱不罕见!近年来,斑马鱼+基因编辑技术的发展,为罕见病的治疗、药物研发及机制研究等提供了新的可能性。
参考文献:
1. Liu C, Cao R, Xu Y, Li T, Li F, Chen S, Xu R, Sun K. Rare copy number variants analysis identifies novel candidate genes in heterotaxy syndrome patients with congenital heart defects. Genome Med. 2018 May 30;10(1):40.
2. Huang H, Liu J, Zhang G. A novel de novo mutation in COL1A1 leading to osteogenesis imperfecta confirmed by zebrafish model. Clin Chim Acta. 2021 Jun;517:133-138.
3. Zhang Y, Lin Y, Zhang Y, Wang Y, Li Z, Zhu Y, Liu H, Ju W, Cui C, Chen M. Familial atrial myopathy in a large multigenerational heart-hand syndrome pedigree carrying an LMNA missense variant in rod 2B domain (p.R335W). Heart Rhythm. 2022 Mar;19(3):466-475.
4. Lin Q, Zhou R, Meng P, Wu L, Yang L, Liu W, Wu J, Cheng Y, Shi L, Zhang Y. Establishment of a Bernard-Soulier syndrome model in zebrafish. Haematologica. 2022 Jul 1;107(7):1655-1668.