基因组学研究成果让斑马鱼研究快马加鞭(Genomics: Zebrafish earns its stripes)
作者:谢训卫 发布时间:2013/4/24 4:00:00人类发育,生理功能及疾病发生的过程涉及到成千上万的基因和其变异体,但是大部分的基因和其变异体的功能依然是未知的。过去的20年里,斑马鱼逐渐成为研究人类基因功能的重要模式动物。在《自然》杂志网站发表的两篇文章里1,2,报道了斑马鱼参考基因组序列和完成超过10,000个蛋白编码基因的断裂性突变体的鉴定,与最近的研究报道一起将有力地促进人类疾病研究3-7。
常见的研究基因功能的手段是确定某个特定的突变对机体表型的影响,如骨骼,生理机能和行为模式等。斑马鱼胚胎和幼鱼具有个体小,易于获取,胚体透明等特点,可以在单细胞水平上进行大量活体检测分析,十分适于此种研究。斑马鱼基因功能大部分是通过“正向遗传学”手段揭示的,首先在斑马鱼基因组中引入随机突变,在子代中鉴定表型的改变8,9(fig. 1a)。使用这种方法鉴定致畸突变工作量很大,但在很大程度上帮助人们揭示了从胚胎发育到心脏生理机能调控等众多遗传途径。
由Howe et al研究人员报道的高质量的斑马鱼基因组序列1,使得将突变序列和野生序列直接进行比对变为可行,将极大地促进突变的鉴定。斑马鱼基因组序列显示75%的人类疾病相关基因都可以在斑马鱼中找到同源基因,从而我们可以利用斑马鱼进行疾病相关基因的功能研究。
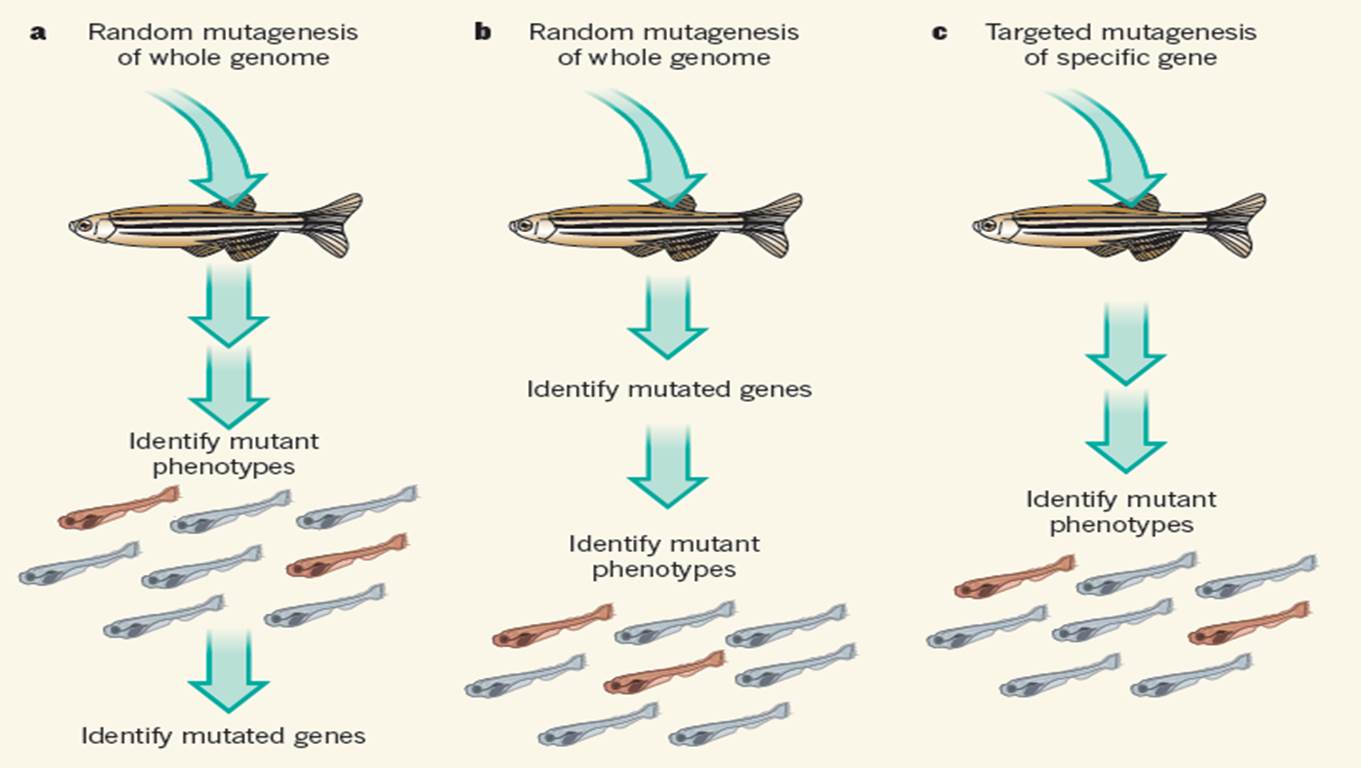
Figure 1表型与基因的联系。斑马鱼中常见的三种研究特定基因在机体表型中功能的方法。a, 正向遗传学,向成年鱼中引入随机突变,在子代中鉴定表型变异,分析基因组以寻找突变基因。b, 另一种方法是先进行随机突变,但接下来对子代全基因组序列比对以寻找突变,进而确定表型的改变。c, 针对特定靶基因的突变技术,向某个特定的基因引入突变再分析子代的表型。
但是如何在斑马鱼中研究一个特定的人类基因的功能呢?首先需要向斑马鱼同源基因引入突变,接下来进行表型分析(fig. 1b)。Kettleborough et al 证实了可以大规模地进行类似的实验2。该作者将雄性斑马鱼进行随机突变,随后对子代基因组DNA的蛋白质编码区域进行测序。在1,673尾鱼中,研究人员鉴定出10,043个基因(超过1/3的所有斑马鱼蛋白编码基因)存在着破坏。这些突变品系将成为系统研究这些基因功能的宝贵资源。
另一种研究基因功能的方法是针对特定基因引入突变,而不是向整个基因组引入随机突变(fig. 1c)。随着在特定位点剪切DNA的技术的出现和完善,基因突变技术发生了根本性的变化。最新报道的技术是CRISPR-Cas9系统,已成功应用于斑马鱼4,5。该技术的核心是一个与靶基因的部分序列互补的RNA分子,引导核酸内切酶到靶基因的特定DNA位点,进行剪切,进而通过易错修复机制引入突变。CRISPR-Cas9系统相对大规模的突变筛选要便宜,快速些,可以被较小的实验室采用。因此大部分的斑马鱼基因相应突变体的产生只是一个时间的问题。
虽然有这些突破性的发现,但我们对于有多少基因在发生破坏时会产生相应的表型还不太清楚。根据之前的正向遗传学筛选结果,推测有大约有不到10%斑马鱼基因的破坏会在胚胎和幼鱼期的前5天产生异常表型9,10。与之一致的是,Kettleborough et al发现在超过800个基因中2,仅有大约5%的基因是这个时期正常发育所必需的。
是否这意味着超过90%的斑马鱼基因是功能无关的?以下有几点考虑使得这个说法完全站不住脚。首先,Kettleborough和同事们在进行表型分析时仅包括了十分明显的结构上的特征,相对细微的表型经常被忽略掉。其次,许多基因仅在晚期发育或成年期中发挥功能。第三,在早期发育时期,基因功能的破坏常被存在于卵黄或胚体中的母源因子所补偿。最后一点,具有相似序列的基因通常拥有重叠或部分冗余的功能,导致单个基因的破坏没有表型或是只有轻微的表型。
Howe et al 发现1/4的斑马鱼基因拥有高序列相似性的同源基因,说明上述最后一点在斑马鱼中尤其适用。然而,所有这些可能性都可以通过可应用于斑马鱼的精细技术来解决:表型的分析可使用高分辨率的拍摄技术和基因表达谱;突变鱼可用于发育晚期的研究;产生无母源和合子期基因表达的突变鱼,或在同一机体中同时敲除2-3个相关基因相对变得容易。
这些工具和资源将如何加速人类疾病相关基因的研究?方法很明了,寻找人类疾病相关基因在斑马鱼中的同源基因并进行编辑,分析异常表型,使用高通量的药物筛选平台寻找或鉴定可以调节该表型改变的小分子化合物11。另外,斑马鱼基因组序列的完成,使得我们可以使用新的研究手段去解决长期以来困扰人类的问题。比如,斑马鱼具有很高比例的遗传变异——Howe et al发现在不同的品系甚至于在不同的个体中,每隔200bp就有一个变异1。在其他生物体中的研究显示这样的差异会导致表型效应。可以想象斑马鱼将成为研究轻微基因型变异在表型差异中的作用的一个有用的脊椎模式动物。
斑马鱼基因组序列的完成是否会在生物学中引入新观念?非常有可能。很明显人类基因组序列的公布并没有带来很大的改变。比如,没有人预测大量的非编码蛋白的RNA分子在功能调控中的重要作用,或是预见使用基因组序列去重建人类进化史12?斑马鱼基因组序列和突变体的收集也许是下一个重大发现的前兆。
Alexander F. Schier现就职于哈佛大学分子与细胞学系,剑桥镇,马萨诸塞州 02138,USA
Email: [email protected]
1 Howe, K. et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature, doi:10.1038/nature12111 (2013).
2 Kettleborough, R. N. et al. A systematic genome-wide analysis of zebrafish protein-coding gene function. Nature, doi:10.1038/nature11992 (2013).
3 Varshney, G. K. et al. A large-scale zebrafish gene knockout resource for the genome-wide study of gene function. Genome research 23, 727-735, doi:10.1101/gr.151464.112 (2013).
4 Hwang, W. Y. et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nature biotechnology 31, 227-229, doi:10.1038/nbt.2501 (2013).
5 Chang, N. et al. Genome editing with RNA-guided Cas9 nuclease in Zebrafish embryos. Cell research 23, 465-472, doi:10.1038/cr.2013.45 (2013).
6 Zu, Y. et al. TALEN-mediated precise genome modification by homologous recombination in zebrafish. Nature methods 10, 329-331, doi:10.1038/nmeth.2374 (2013).
7 Bedell, V. M. et al. In vivo genome editing using a high-efficiency TALEN system. Nature 491, 114-118, doi:10.1038/nature11537 (2012).
8 Driever, W. et al. A genetic screen for mutations affecting embryogenesis in zebrafish. Development 123, 37-46 (1996).
9 Haffter, P. et al. The identification of genes with unique and essential functions in the development of the zebrafish, Danio rerio. Development 123, 1-36 (1996).
10 Solnica-Krezel, L., Schier, A. F. & Driever, W. Efficient recovery of ENU-induced mutations from the zebrafish germline. Genetics 136, 1401-1420 (1994).
11 Zon, L. I. & Peterson, R. T. In vivo drug discovery in the zebrafish. Nature reviews. Drug discovery 4, 35-44, doi:10.1038/nrd1606 (2005).
12 Lander, E. S. Initial impact of the sequencing of the human genome. Nature 470, 187-197, doi:10.1038/nature09792 (2011).